Kemasan obat selain berfungsi untuk melindungi obat dari pengaruh lingkungan untuk menjaga mutunya juga menjadi sumber informasi bagi pengguna baik pasien maupun tenaga kesehatan tentang obat yang terkandung di dalamnya. Informasi ini penting untuk diketahui pengguna mengingat obat memiliki aturan pakai yang cukup kompleks. Kesalahan dalam penggunaan obat dapat berakibat fatal bagi pasien. Mengingat pentingnya informasi pada kemasan obat, BPOM dan Kemenkes mengeluarkan beberapa aturan terkait informasi pada kemasan obat tersebut sehingga menjadi standar bagi industri farmasi dalam mendesain kemasan obat.
Informasi pada kemasan ini tidak
terbatas pada kemasan primer saja, namun juga pada kemasan sekunder dan leaflet
obat (termasuk juga informasi obat untuk pasien atau PIL (Patient Information
Leaflets) apabila dipersyaratkan). Informasi minimal yang harus dicantumkan
pada kemasan obat diatur dalam buku cokelat atau Peraturan Kepala Badan
Pengawas Obat dan Makanan Republik Indonesia Nomor 24 Tahun 2017 tentang
Kriteria dan Tata Laksana Registrasi Obat sedangkan aturan penulisan nama obat
diatur dalam Keputusan Menteri Kesehatan Republik Indonesia Nomor
068/MENKES/SK/II/2006 tentang Pedoman Pelaksanaan Pencantuman Nama Generik Pada
Label Obat. Selain itu juga terdapat aturan pencantuman harga eceran tertinggi
(HET) yang diatur dalam Keputusan Menteri Kesehatan Republik Indonesia Nomor
068/MENKES/SK/II/2006 tentang Pencantuman Harga Eceran Tertinggi (HET) Pada
Label Obat.
Berdasarkan buku cokelat yang
dimaksud dengan leaflet atau brosur atau ringkasan karakteristik produk adalah
informasi lengkap yang disetujui oleh Kepala BPOM terkait deskripsi 0bat,
khasiat dan keamanan obat dari data hasil uji klinik, dan informasi lain yang
dianggap perlu serta berfungsi sebagai sumber informasi bagi petugas kesehatan
dan menjadi acuan dalam penyusunan informasi produk untuk pasien. Sedangkan informasi
produk untuk pasien atau PIL adalah informasi untuk pasien yang disetujui oleh
Kepala BPOM terkait khasiat, keamanan dan cara penggunaan 0bat serta informasi
lain yang dianggap perlu dengan menggunakan bahasa Indonesia yang mudah
dimengerti dan dipahami oleh pasien. Biasanya informasi produk untuk pasien ini
berupa tanya jawab untuk lebih mempermudah pasien memahami informasi obat
tersebut.
Informasi apa saja yang harus tercantum pada brosur?
Di dalam Lampiran X Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 24 tahun 2017 terdapat aturan informasi minimal yang harus dicantumkan pada informasi produk yaitu sebagai berikut:
A. Ringkasan karakteristik produk/brosur
- Nama Obat
- Bentuk sediaan
- Pemerian Obat
- Komposisi Obat (nama dan kekuatan Zat Aktif)
- Indikasi
- Posologi dan cara pemberian
- Kontraindikasi
- Peringatan – Perhatian
- Interaksi Obat
- Kehamilan dan menyusui
- Efek pada pengendara dan menjalankan mesin (jika perlu)
- Efek samping
- Overdosis dan pengobatan (jika ada)
- Cara kerja Obat, dan/atau Farmakodinamik dan/atau Farmakokinetik
- Data keamanan nonklinik (jika perlu)
- Daftar Eksipien
- Ketidaktercampuran (jika perlu)
- Cara penyimpanan
- Stabilitas/batas penggunaan setelah direkonstitusi atau setelah wadah dibuka (in use stability) (jika perlu)
- Jenis dan besar kemasan
- Bentuk sediaan dan kemasan lain yang terdaftar (jika perlu)
- Nomor Izin Edar
- Nama Pendaftar dan/atau pemilik Obat sesuai dengan ketentuan yang berlaku
- Alamat Pendaftar dan/atau pemilik Obat sesuai dengan ketentuan yang berlaku
- Nama produsen
- Alamat produsen
- Nama industri pemberi lisensi (jika perlu)
- Alamat industri pemberi lisensi (jika perlu)
- Petunjuk penggunaan
- Cara rekonstitusi (jika ada)
- Tanggal disetujui pertama kali/Registrasi Ulang (jika perlu)
- Tanggal perubahan Informasi Produk (jika perlu)
- Golongan Obat
- Peringatan khusus, misalnya:
- Harus dengan resep dokter
- Tanda peringatan Obat bebas terbatas (P.No.1- P.No.6)
- Kotak peringatan
- Bersumber/bersinggungan babi
- Kandungan alkohol
B. Informasi produk untuk pasien
- Nama Obat
- Bentuk sediaan
- Pemerian Obat
- Komposisi Zat Aktif/Apa yang terkandung dalam Obat?
- Kekuatan Obat
- Indikasi/Untuk apa Obat digunakan?
- Posologi dan cara pemberian/Berapa banyak dan seberapa sering Obat ini boleh digunakan? Apa yang harus dilakukan bila lupa minum Obat ini?
- Kontraindikasi/Pada keadaan apa Anda tidak diperbolehkan menggunakan Obat ini?
- Peringatan dan Perhatian/Apa yang perlu diperhatikan bila menggunakan Obat ini? (seperti: apa yang terjadi jika Obat dihentikan)
- Interaksi Obat/Obat dan makanan apa yang harus dihindari jika menggunakan Obat ini?
- Kehamilan dan menyusui/Apakah boleh digunakan pada wanita hamil dan menyusui?
- Efek pada pengendara dan menjalankan mesin/Apakah boleh mengendarai dan menjalankan mesin selama minum Obat ini? (jika perlu)
- Efek samping/Efek yang tidak diinginkan yang mungkin terjadi
- Overdosis/Tanda dan gejala kelebihan dosis (jika perlu)
- Pengobatan overdosis/Apa yang harus dilakukan bila menggunakan Obat ini melebihi dosis yang dianjurkan? (jika perlu)
- Cara penyimpanan/Bagaimana cara menyimpan Obat ini?
- Batas penggunaan setelah direkonstitusi atau setelah wadah dibuka/ Berapa lama Obat ini dapat digunakan setelah kemasan dibuka? (jika perlu)
- Petunjuk penggunaan
- Cara rekonstitusi/Bagaimana cara melarutkan Obat ini? (jika perlu)
- Nomor Izin Edar
- Nama Pendaftar dan/atau pemilik Obat sesuai dengan ketentuan yang berlaku
- Alamat Pendaftar dan/atau pemilik Obat sesuai dengan ketentuan yang berlaku
- Tanggal perubahan (jika perlu)
- Peringatan Khusus, misalnya:
- Harus dengan resep dokter
- Tanda peringatan Obat bebas terbatas (P. No. 1 - P. No. 6)
- Kotak peringatan
- Bersumber/bersinggungan babi
- Kandungan alkohol
Untuk obat copy (obat generik)
penulisan leaflet dan PIL disesuaikan dengan obat inovatornya dengan
menghilangkan data uji klinisnya.
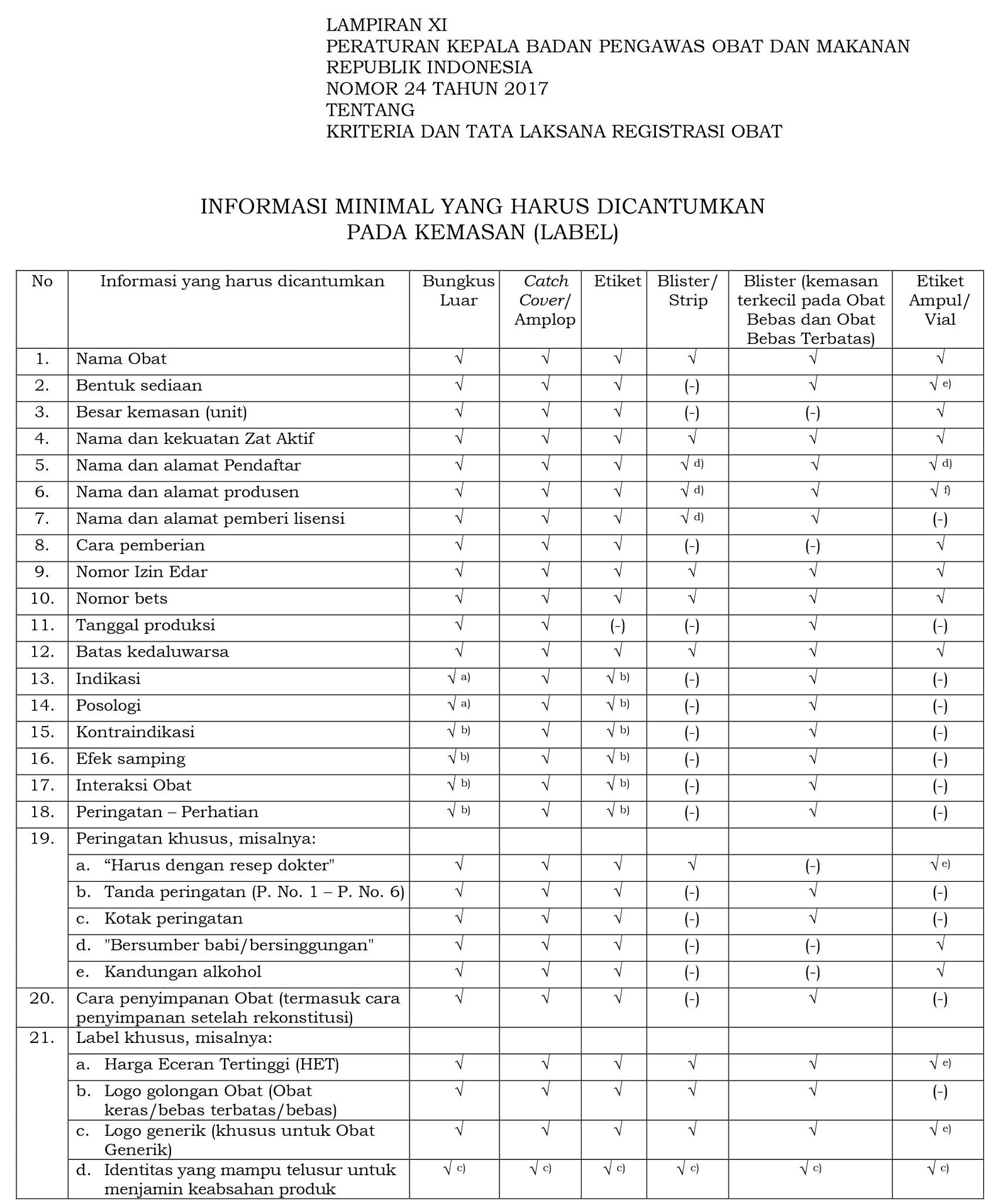
Informasi apa saja yang harus tercantum pada kemasan primer dan sekunder obat?
Informasi minimal yang harus tercantum pada kemasan obat terdapat dalam Lampiran XI Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 24 tahun 2017 yang dapat dilihat pada gambar di bawah ini.
Bagaimana aturan pencantuman 2D Barcode Pada Kemasan?
Berdasarkan Peraturan Badan Pengawas Obat dan Makanan Nomor 33 Tahun 2018 tentang Penerapan 2D Barcode Dalam Pengawasan Obat dan Makanan disebutkan bahwa 2D Barcode dicetak pada kemasan dengan tinta warna hitam dan dasar warna putih atau warna lain. 2D Barcode tersebut wajib dicantumkan dalam kemasan primer kecuali:
- volume di bawah 10 ml
- kemasan primer blister
- kemasan primer strip
- kemasan ampul
- prefilled syringe
- kemasan tube yang memiliki berat bersih dibawah 10 gram
- kemasan tunggal
- stick pack
- suppositoria
- catch cover
Bagaimana aturan penulisan nama obat menurut Kepmenkes?
Aturan penulisan nama obat diatur tersendiri dalam Kepmenkes Nomor 068/MENKES/SK/II/2006 tentang Pedoman Pelaksanaan Pencantuman Nama Generik Pada Label Obat sebagai berikut:
- Pencantuman nama generik pada label obat diterapkan hingga kemasan terkecil.
- Pencantuman nama generik tersebut berlaku untuk obat OTC maupun ethical.
- Ukuran huruf nama generik 80% (tinggi dan tebal) dari pada ukuran huruf nama dagang dengan jenis huruf dan warna huruf yang sama, penulisan nama generik tepat di bawah nama dagang.
- Pencantuman nama generik berlaku untuk obat dengan komposisi tunggal maupun lebih dari 1 zat aktif.
- Untuk obat dengan komposisi 1-5 zat aktif, seluruh zat aktif harus ditulis di bawah nama dagang. Penulisan boleh berbaris ke bawah atau berjajar ke samping dengan dipisahkan tanda (+), (,), atau (;).
- Jika terdiri lebih dari 5 zat aktif, untuk multivitamin dapat dicantumkan kata “multivitamin”, berbagai mineral dapat dicantumkan kata “mineral”, berbagai enzim dapat dicantumkan kata “enzim”.
- Pencantuman nama generik disesuai dengan INN (Non Proprietary Name). Nama generik boleh menggunakan singkatan lazim seperti Cetirizine HCl.
- Pencantuman HET diterapkan hingga kemasan terkecil.
- Pencantuman HET berlaku pada obat OTC maupun ethical.
- HET yang dicantumkan merupakan harga maksimum per kemasan.
- Bila kemasan satuan seperti 1 botol sirup, 1 tube krim, 1 ampul, 1 vial, 1 botol infus, dicantumkan sebagai: HET = Rp. Xxx
- Bila kemasan blister atau strip terdiri dari 10 tablet, dicantumkan sebagai: HET untuk 10 tablet = Rp. Xxx
- Bila kemasan curah dalam kaleng atau botol yang berisi 100 tablet, dicantumkan sebagai: HET untuk 100 tablet = Rp. Xxx
- Pencantuman HET dilakukan dengan ukuran yang cukup besar dan warna yang jelas sehingga mudah dibaca.
- Pencantuman HET diletakkan pada tempat yang mudah terlihat.
- Pencantuman dapat dilakukan dengan dicap menggunakan tinta permanen yang tidak dapat dihapus atau dicetak pada kemasan.


Post a Comment